Karina Toledo | Agência FAPESP – Estudo brasileiro divulgado na revista Molecular Human Reproduction ajuda a entender por que filhos de mães obesas são mais propensos a desenvolver doenças metabólicas ao longo da vida, como pesquisas anteriores haviam sugerido.
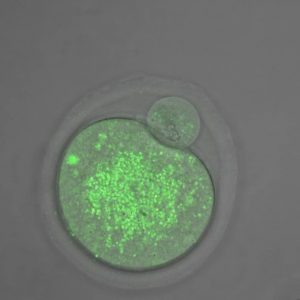
Fenômeno pode estar relacionado com a deficiência de uma proteína chamada mitofusina-2 no óvulo materno, que afeta a forma e o funcionamento das mitocôndrias. Conclusão se baseia em experimentos com camundongos conduzidos na UFSCar e descritos na revista Molecular Human Reproduction ( imagem: Óvulo deficiente de mitofusina-2. A marcação em verde representa as mitocôndrias em número reduzido, agregadas e inchadas em relação a óvulos de controle. Crédito: Marcos Chiaratti)
Segundo os autores, esse fenômeno de “transmissão transgeracional de doenças” pode estar relacionado com a deficiência de uma proteína chamada mitofusina-2 no óvulo materno. Normalmente, essa molécula é encontrada na membrana externa das mitocôndrias. Sua ausência faz com que essas organelas responsáveis pelo fornecimento de energia para a célula fiquem inchadas e disfuncionais, além de alterar a expressão de quase mil genes no gameta feminino.
“A mitofusina-2 tem sido apontada em diversos estudos como um importante regulador metabólico. Há evidências de que, à medida que um indivíduo ganha peso, a expressão dessa proteína diminui nas células do músculo e do fígado – dois tecidos importantes para a regulação das taxas de glicemia. E também em portadores de diabetes a expressão de mitofusina-2 está reduzida nessas células”, conta Marcos Chiaratti, professor do Departamento de Genética e Evolução da Universidade Federal de São Carlos (UFSCar) e coordenador da pesquisa, apoiada pela FAPESP.
No artigo recém-publicado, o grupo liderado por Chiaratti descreve resultados de experimentos com camundongos geneticamente modificados para não expressar a mitofusina-2 apenas no gameta feminino (célula também chamada de oócito ou óvulo). Embora a deficiência da proteína não tenha afetado a fertilidade das fêmeas, como se imaginava inicialmente, os filhotes por elas gerados apresentaram maior ganho de peso em comparação aos descendentes dos animais controle e, após nove semanas de vida, mesmo alimentados com uma dieta padrão, haviam se tornado diabéticos.
Para desvendar os mecanismos moleculares associados a esse fenótipo anormal, Chiaratti estabeleceu uma colaboração com integrantes do Centro de Pesquisa em Processos Redox em Biomedicina (Redoxoma) e do Centro de Pesquisa em Obesidade e Comorbidades (OCRC) – dois Centros de Pesquisa, Inovação e Difusão (CEPIDs) financiados pela FAPESP. Parte do trabalho foi feita durante o mestrado de Bruna Garcia, no Centro de Ciências Biológicas e da Saúde (CCBS) da UFSCar, sob orientação de Chiaratti.
O primeiro passo foi avaliar que tipo de disfunção o óvulo deficiente de mitofusina-2 apresentava ao atingir o estágio em que se encontra pronto para ser fecundado. As análises revelaram que o número de mitocôndrias estava reduzido nessas células, assim como a quantidade de ATP (trifosfato de adenosina, molécula usada como combustível celular) produzida.
Os pesquisadores também notaram que as mitocôndrias dos gametas estavam mais agregadas do que o normal, tinham o dobro do tamanho esperado e apresentavam-se mais distante do retículo endoplasmático – organela com a qual precisam interagir para importar cálcio e outras substâncias importantes para seu funcionamento.
De acordo com Chiaratti, uma das funções conhecidas da mitofusina-2 é garantir que a mitocôndria se mantenha em contato com o retículo endoplasmático – estrutura que participa da síntese e do transporte de diversas substâncias dentro da célula. Os resultados da pesquisa sugerem que a deficiência dessa molécula compromete a interação entre as duas organelas, prejudicando a função de ambas no gameta.
“Há evidências de que o fenômeno de transmissão transgeracional de doenças como o diabetes está associado à disfunção mitocondrial e ao estresse de retículo endoplasmático no óvulo. Nossos achados corroboram essa hipótese”, diz o pesquisador à Agência FAPESP. “A falta da mitofusina-2 parece afetar a biogênese mitocondrial [e por isso o número de organelas é menor] e também a capacidade da mitocôndria de se locomover no citoplasma e atender a demanda energética da célula”, acrescenta.
O passo seguinte foi caracterizar o transcriptoma [conjunto de moléculas de RNA expressas pelos genes] do óvulo sem mitofusina-2 e compará-lo com o controle. Por meio de uma técnica de sequenciamento de RNAs, os pesquisadores descobriram que 517 genes estavam com expressão diminuída no gameta do animal modificado e outros 426 genes estavam mais ativos em comparação ao controle.
“Fomos então olhar a quais vias de sinalização pertenciam esses genes diferencialmente expressos. Encontramos vias ligadas ao funcionamento do retículo endoplasmático e da mitocôndria, além de vias associadas a processos endócrinos, como a regulação da glicemia”, conta Chiaratti.
Alterações na prole
As análises feitas com os descendentes das fêmeas geneticamente modificadas tiveram como foco as células do músculo esquelético e do fígado. O objetivo era entender por que esses animais haviam se tornado diabéticos mesmo quando alimentados com dieta balanceada.
Nos dois tipos celulares, não se observou a condição conhecida como estresse de retículo endoplasmático – caracterizada por um acúmulo de proteínas no interior da organela que atrapalha seu funcionamento. Também não foram detectadas alterações mitocondriais nas células musculares. Já as mitocôndrias do fígado estavam levemente disfuncionais.
Como essa alteração não era suficiente para explicar o fenótipo hiperglicêmico da prole, o grupo decidiu estudar nesses animais a sinalização de insulina – hormônio produzido no pâncreas que possibilita a entrada de glicose nas células, contribuindo para reduzir a taxa de açúcar no sangue.
Ao analisar as células pancreáticas, concluíram que a produção de insulina estava normal. No entanto, o nível circulante do hormônio estava reduzido e também o sinal que ele normalmente envia para as células musculares e hepáticas.
“Nesses dois tecidos, a insulina causa uma modificação bioquímica em uma proteína chamada AKT [proteína quinase B]. O sinal enviado pela insulina faz com que essa molécula seja fosforilada [ocorre a adição de fosfato à cadeia proteica] e isso ativa uma cascata de reações bioquímicas na célula”, explica Chiaratti.
Os resultados dessas análises sugerem, portanto, que uma quantidade menor de insulina estava chegando ao músculo e ao fígado da prole, embora a quantidade de hormônio produzida pelo pâncreas estivesse normal. Isso levantou a hipótese de que a insulina estivesse sendo degradada mais rapidamente no organismo desses animais, algo que ainda precisará ser confirmado em estudos futuros.
Próximos passos
Para avançar no entendimento dos mecanismos moleculares que levaram ao maior ganho de peso e à hiperglicemia nos filhotes gerados a partir dos óvulos deficientes de mitofusina-2, os pesquisadores pretendem repetir o experimento com algumas modificações. As fêmeas geneticamente modificadas serão alimentadas com dieta hipercalórica para exacerbar os efeitos causados pela deficiência da proteína na prole.
“Também pretendemos investigar, em animais sem qualquer modificação genética, se a dieta hipercalórica sozinha é capaz de reduzir a expressão de mitofusina-2 e alterar a forma e o funcionamento das mitocôndrias, bem como sua interação com o retículo”, adianta Chiaratti.
A expectativa, segundo o pesquisador, é que o conhecimento gerado por esses estudos permita o desenvolvimento de estratégias para manipular a expressão de mitofusina-2 no contexto da obesidade, prevenindo a transmissão transgeracional de doenças metabólicas.
Na avaliação de Alicia Kowaltowski, professora do Instituto de Química da Universidade de São Paulo (IQ-USP), integrante do Redoxoma e coautora do artigo, os resultados obtidos até agora demonstram que o tipo de dieta e o estado nutricional de um indivíduo têm impacto sobre a forma das mitocôndrias – um dos fatores que moldam o funcionamento celular. Segundo a pesquisadora, portanto, proteínas que regulam a forma da mitocôndria são potenciais alvos terapêuticos a serem explorados.
“Vale ressaltar que não encontramos alterações significativas nas mitocôndrias do tecido hepático, apesar de os animais serem diabéticos. Isso vai ao encontro de outros estudos que indicam ser grande a resiliência da função mitocondrial no fígado. Acreditamos que, por se tratar de um órgão central para o metabolismo, existam mecanismos de proteção. Quando a disfunção mitocondrial aparece no fígado é porque a síndrome metabólica já está em fase avançada de desenvolvimento”, comenta Kowaltowski.
Infertilidade e herança materna
Financiado pela FAPESP por meio de diversos projetos (09/54035-4, 12/50231-6, 17/05899-2, 17/04372-0, 16/11935-9, 16/11942-5, 16/07868-4, 18/06119-3 e 10/51906-1), o estudo agora publicado integra uma linha de pesquisa cujo objetivo é entender como eventuais alterações na mitocôndria, incluindo mutações no DNA mitocondrial, estão associadas com a infertilidade e a transmissão de doenças entre gerações.
“Estudos anteriores mostraram que disfunções mitocondriais podem comprometer a fertilidade do óvulo. Para entender melhor esse mecanismo, criamos dois modelos animais. Em um deles inibimos a expressão da proteína mitofusina-1 no óvulo e, no outro, inibimos a mitofusina-2”, relata Chiaratti.
A deficiência de mitofusina-1 tornou as fêmeas inférteis, como descrito em artigo publicado no The Faseb Journal.
“Mostramos, no trabalho anterior, que essa deleção alterou a expressão de 161 genes e afetou vários processos no interior do óvulo, principalmente a comunicação com as células do ovário. Já no caso dos animais deficientes de mitofusina-2 foram observadas outras alterações nos óvulos e na prole, mas não houve impacto na fertilidade”, conta. “Curiosamente, os efeitos da deleção de mitofusina-1 foram amenizados nos óvulos quando a mitofusina-2 foi simultaneamente inibida, sugerindo que a ação da mitofusina-1 ocorre após a da mitofusina-2.”
O artigo Mice born to females with oocyte-specific deletion of mitofusin 2 have increased weight gain and impaired glucose homeostasis pode ser lido em https://academic.oup.com/molehr/advance-article-abstract/doi/10.1093/molehr/gaaa071/5942688.


